| Die Tauchphysik... |
|
|
|
Der Umgebungsdruck... |
|
|
| Wasser ist ca. 800 mal dichter als Luft. 1 Liter Wasser hat eine Gewichtskraft von 10 N. Da die Dichte des Wassers (fast) nicht vom Druck abhängt, steigt der Druck für jede weiteren 10 m Tauchtiefe um 1 bar an. |
|
|
| Tiefe | Umgebungsdruck |
| 0 m | 1 bar |
| 10 m | 2 bar |
| 20 m | 3 bar |
| 40 m | 5 bar |
Daraus ergibt sich folgende Faustformel:
Umgebungsdruck = [(Tauchtiefe / 10) + 1] bar
Zum Rechenbeispiel hier klicken...
|
Gase und ihre Gesetze...(Das Gesetz von Dalton) |
|
|
|
Chemische Zusammensetzung der Atemluft |
|
|
|
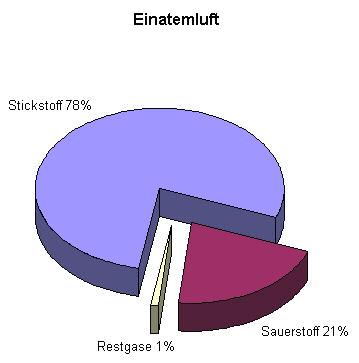
Unsere Einatemluft ist ein Gemisch verschiedener Gase mit folgender Zusammensetzung: |

|
|
|
Entsprechend diesem Anteil haben die Gase auch einen Anteil an ihrem Umgebungsdruck. Auf Meerehöhe (1 bar) hat beispielsweise der Sauerstoff einen Teildruck von 21%, also 0,21 bar, und der Stickstoff einen Teildruck (auch Partialdruck genannt) von 0,78 bar. |
|
|
|
|
| Tiefe | Umgebungsdruck | O2 Teildruck | N2 Teildruck |
| 0 m | 1 bar | 0,21 bar | 0,78 bar |
| 10 m | 2 bar | 0,42 bar | 1,56 bar |
| 20 m | 3 bar | 0,63 bar | 2,34 bar |
| 30 m | 4 bar | 0,84 bar | 3,12 bar |
| Zum Rechenbeispiel hier klicken... | |||
|
Druck und Volumen...(Das Gesetz von Boyle und Mariotte) |
|
|
|
"Bei gleichbleibender Temperatur steht für eine gegebene Gasmenge der Druck im umgekehrten Verhältnis zum Volumen" |
|
|
|
Anschaulicher bedeutet dies: |
|
|
|
So erhalten wir die Formel: p * V = konstant |
|
|
|
Die Tatsache, daß das Produkt aus Druck und Volumen konstant bleibt, ermöglicht es uns, zwei Zustände unterschiedlichen Drucks bzw. Volumens zu vergleichen. Im Anfangszustand bezeichne p1 den Anfangsdruck und V1 das Anfangsvolumen des Gases. Im Endzustand bezeichnen wir mit p2 den Enddruck und mit V2 das Endvolumen des Gases. Da wir wissen, daß das Produkt aus Druck und Volumen gleich bleibt, gilt die Beziehung p1 * V1 = p2 * V2. Falls uns von diesen vier Größen drei bekannt sind, können wir so anhand dieser Formel die fehlende Größe berechnen. |
|
|
|
Zum Rechenbeispiel hier klicken... |
|
Das Gesetz von Gay-Lussac |
|
|
|
"Bei konstantem Volumen wächst der Druck einer gegebenen Gasmenge im gleichen Verhältnis wie die absolute Temperatur" |
|
|
|
Genauer lautet das Gesetz, daß sich Gase bei 1 Grad Temperaturerhöhung im 1/273 ihres Anfangvolumens beo 0 °C ausdehnen. Ist ein Ausdehnen nicht möglich, so erhöht sich entsprechend der Druck. Dies führt auf die oben beschriebene Gesetzmäßigkeit. |
|
|
|
Bei der Erwärmung von Gasen nimmt die Geschwindigkeit der Moleküle zu. Nicht eingeschlossene Gase dehnen sich räumlich aus. Bei eingeschlossenen Gasen (konstantes Volumen) wächst der Druck einer gegebenen Gasmenge im gleichen Verhältnis wie die absolute Temperatur T. Doppelte Kelvin-Temperatur bedeutet also doppelten Druck! Teilt man den Druck durch die absolute Temperatur (Kelvin), so ist dieser Wert für ein abgeschlossenes, starres Volumen konstant p / T = konstant |
|
|
|
Bezeichnen wir Druck und Temperatur vor einer angenommenen Erwärmung mit p1 und T1 und nach der Erwärmung mit p2 und T2 dann gilt: p1 / T1 = p2 / T2 Die Umrechnung der Celsius-Temperatur |
|
|
|
T = ( |
|
|
|
|
|
Zum Rechenbeispiel hier klicken... |